| chemie-master.de: CD-ROM-Fassung bestellen |
Das Periodensystem der Elemente für den Schulgebrauch |
zurück |
| Uran | |
7. Periode _______________ |
|
|
|
|
| Elementart: Metall | Oxidationsstufe(n): +6 (+3, +4, +5) |
| Schmelztemperatur: 1132,2 °C (1405,3 K) | Elektronegativität: 1,4 |
| Siedetemperatur: 3927 °C (4200 K) | Atomradius: 139 pm |
| Dichte: 19,05 g/cm3 | Erdkrustenhäufigkeit: 3×10–4 % |
| Anordnung der Elektronen | |||||||||||||||||||
| 1s | 2s | 2p | 3s | 3p | 3d | 4s | 4p | 4d | 4f | 5s | 5p | 5d | 5f | .. | 6s | 6p | 6d | ... | 7s |
| 2 | 2 | 6 | 2 | 6 | 10 | 2 | 6 | 10 | 14 | 2 | 6 | 10 | 3 | 2 | 6 | 1 | 2 | ||
| Name | Benannt nach dem 1781 entdeckten Planeten Uranus. | ||||||||||
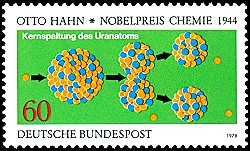
| Entdeckung | 1789 von Klaproth in Pechblende entdeckt. | ||||||||||
| Eigenschaften | Uran ist ein silberglänzendes, weiches, radioaktives Metall. Es bildet eine Vielzahl verschiedener Legierungen. Uran ist sehr reaktionsfähig. Es reagiert - bei unterschiedlichen Temperaturen - mit Wasserstoff, Kohlenstoff, Silicium, Stickstoff, Sauerstoff, Schwefel, den Halogenen, mit Wasser u.a. Bei Raumtemperatur läuft auch massives Uranmetall an der Luft an. Dabei bilden sich gelbe und schwarze Oxide. Uran als feines Pulver entzündet sich teilweise spontan. In siedendem Wasser korrodiert massives Uran langsam unter Bildung von Urandioxid und Wasserstoff.  Abgereichertes metallisches Uran ("depleted uranium", "DU"). Beim Aufbewahren an der Luft bildet sich auf dem Metall eine schwarze Oxidschicht.
Salpetersäure löst auch größere Stücke Uran schnell unter Bildung von Uranyl(VI)-nitrat. Konzentrierte Phosphorsäure sowie heiße Schwefelsäure greifen Uran nur langsam an. Bei der Reaktion mit Schwefelsäure entsteht Uran(IV)-sulfat. Gegenüber kalter, verdünnter Perchlorsäure (HClO4) ist Uran beständig. Konzentrierte Salzsäure (HCl) sowie Bromwasserstoffsäure (HBr) greifen Uranmetall schnell unter Bildung eines schwarzen Rückstands an, der auch beim Erhitzen nicht verschwindet.Foto: Dr. Andreas Kronenberg, Los Alamos National Laboratory, USA 
|
||||||||||
| Vorkommen | Im Monazitsand sowie in Uranpechblende und Carnotit (vor allem in den USA, Kanada, GUS-Staaten und Südafrika). Foto: Dr. Andreas Kronenberg, Los Alamos National Laboratory, USA  "Yellowcake", ein Uransalzgemisch, entsteht bei der Aufbereitung von Uranerzen. |
||||||||||
| Verbindungen | Wichtige Verbindungen sind das Uranhexafluorid (UF6) und die Uranoxide UO2 (Kernbrennstoff für Leichtwasserreaktoren), U3O8, UO3 sowie das Uranperoxid (UO4). Uranhexafluorid kann - abhängig von Druck und Temperatur - fest, flüssig oder gasförmig vorliegen. Bei Atmosphärendruck ist es bis zu einer Temperatur von |
||||||||||
| Verwendung |
Zur gelben, orangen oder schwarzen Färbung von Glas und Keramik wurden früher Uranverbindungen eingesetzt. Fotos: Dr. Andreas Kronenberg, Los Alamos National Laboratory, USA
 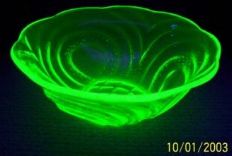 Uran(VI)-oxid UO3 färbt Glasflüsse gelb. Bei Bestrahlung mit UV-Licht tritt grüne Fluoreszenz auf.
|
||||||||||
| Isotope |  Nur Radionuklide, keine stabilen Isotope. Nur Radionuklide, keine stabilen Isotope.
|
||||||||||
| Redox-Potenziale |
|
||||||||||
 |
© chemie-master.de - Website für den Chemieunterricht | Seitenübersicht| Lizenz & Urheberrecht| Arbeitsblätter | | Danksagungen | Kritik | Links | |
 |
| Quellenangabe für diese Seite: http://www.chemie-master.de/pse/pse.php?modul=U [Stand 28.02.2026] |
||
 |
||