| chemie-master.de: CD-ROM-Fassung bestellen |
Das Periodensystem der Elemente für den Schulgebrauch |
zurück |
| Seaborgium | |
(Chromgruppe) 7. Periode _______________ 6. Gruppe (IUPAC 89) |
|
|
|
|
| Elementart: Metall | Oxidationsstufe(n): – |
| Schmelztemperatur: – | Elektronegativität: – |
| Siedetemperatur: – | Atomradius: – |
| Dichte: – | Erdkrustenhäufigkeit: künstlich |
| Anordnung der Elektronen (Siehe auch: Relativistische Effekte und Energieniveauschema) | |||||||||||||||||||
| 1s | 2s | 2p | 3s | 3p | 3d | 4s | 4p | 4d | 4f | 5s | 5p | 5d | 5f | .. | 6s | 6p | 6d | ... | 7s |
| 2 | 2 | 6 | 2 | 6 | 10 | 2 | 6 | 10 | 14 | 2 | 6 | 10 | 14 | 2 | 6 | 4 | 2 | ||
| Name | Nach dem amerikanischen Chemiker und Nobelpreisträger Glenn T. Seaborg benannt. Glenn T. Seaborg (1912-1999, Mitentdecker von Plutonium, Americium, Curium, Berkelium, Californium, Einsteinium, Fermium, Mendelevium und Nobelium) zeigt auf das Element Seaborgium im Periodensystem. Er ist der einzige Wissenschaftler, nach dem zu seinen Lebzeiten ein chemisches Element benannt wurde. |
| Entdeckung | Erstmals 1974 künstlich erzeugt von einer Arbeitsgruppe unter Leitung von Ghiorso im Lawrence Berkeley Laboratorium in Berkeley (Kalifornien): 249Cf + 18O Die winzige Menge Seaborgium, die dabei entstand, zerfiel in weniger als einer Sekunde. Aus seinen Rückständen konnte das Isotop mit 157 Neutronen identifiziert werden. Quelle: Dr. Kronenberg, Los Alamos National Laboratory, USA 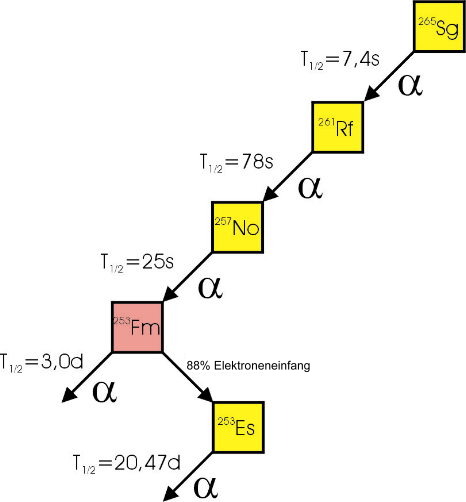 Zerfallskette von 265Sg. Die Identifizierung neu gebildeter Atomkerne geschieht in der Weise, dass beim Auftreffen von Kernen auf einem Detektor, deren Energie und die von ihnen ausgehende a-Strahlung (Heliumkerne) registriert werden. Entsprechend werden die Daten für die weiteren Zerfälle ("Tochterzerfälle") aufgezeichnet. Massenzahl und Kernladungszahl des ursprünglich gebildeten Kerns können bestimmt werden, indem man die jeweils ausgesandten Heliumkerne (a-Strahlung) zu den identifizierten Zerfallsprodukten hinzuaddiert. |
| Eigenschaften | Die erste Untersuchung zur wässrigen Chemie von Seaborgium wurde mit Information: Dr. A. Kronenberg |
| Isotope |  Nur Radionuklide, keine stabilen Isotope. Nur Radionuklide, keine stabilen Isotope.Die beiden wichtige Seaborgium-Isotope 266Sg (160 Neutronen) mit einer Halbwertszeit von |
 |
© chemie-master.de - Website für den Chemieunterricht | Seitenübersicht| Lizenz & Urheberrecht| Arbeitsblätter | | Danksagungen | Kritik | Links | |
 |
| Quellenangabe für diese Seite: http://www.chemie-master.de/pse/pse.php?modul=Sg [Stand 28.02.2026] |
||
 |
||