| chemie-master.de: CD-ROM-Fassung bestellen |
Das Periodensystem der Elemente für den Schulgebrauch |
zurück |
| Barium | |
(Erdalkalimetalle) 6. Periode _______________ 2. Gruppe (IUPAC 89) |
|
|
|
|
| Elementart: Metall | Oxidationsstufe(n): +2 |
| Schmelztemperatur: 725 °C (998 K) | Elektronegativität: 0,9 |
| Siedetemperatur: 1640 °C (1913 K) | Atomradius: 217 pm |
| Dichte: 3,51 g/cm3 | Erdkrustenhäufigkeit: 0,03 % |
| Anordnung der Elektronen | |||||||||||||||||||
| 1s | 2s | 2p | 3s | 3p | 3d | 4s | 4p | 4d | 4f | 5s | 5p | 5d | 5f | .. | 6s | 6p | 6d | ... | 7s |
| 2 | 2 | 6 | 2 | 6 | 10 | 2 | 6 | 10 | 2 | 6 | 2 | ||||||||
| Lewis-Schreibweise | |||||||||||||||||||
| Das Barium-Atom gibt die beiden Außenelektronen ab und bildet ein Ba |
|||||||||||||||||||
| Name | Von »barys«, griech. schwer (nach dem Mineral Schwerspat). |
||
| Entdeckung | 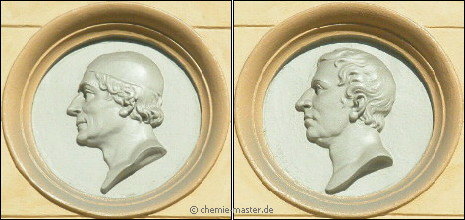 Johan Gottlieb Gahn (1745 - 1818, li.) und Carl Wilhelm Scheele (1742 - 1786, re.).
(Haus des Metallkontors in Stockholm)
|
||
| Eigenschaften | Silberglänzendes Leichtmetall. Aufbewahrung unter Luftabschluss in Paraffinöl.
Die frische Schnittfläche des Bariums verliert an der Luft durch Oxidation sofort ihren metallischen Glanz. Barium reagiert mit Wasser unter Bildung von Hydroxid und Wasserstoff: Ba + 2 H2O Flammenfärbung: fahlgrün. Lösliche Bariumsalze sind giftig. |
||
| Vorkommen | Als Bariumsulfat BaSO4 im Mineral Baryt (Schwerspat).
Foto: www.minerals-online.de  Baryt |
||
| Herstellung | Reduktion von Bariumoxid mit Aluminium oder Silicium im Vakuum. | ||
| Verbindungen | Bariumsulfat BaSO4 ist sehr schwer löslich, wird als Röntgenkontrastmittel, als weißer Füllstoff für Papier und Gummimischungen sowie in Malerfarben verwendet. | ||
| Verwendung | Gasfallen in Vakuumbehältern; in der Feuerwerkerei; in Fluoreszenzlampen; Zusatz zur Aktivierung von Elektroden. | ||
| Isotope | 130Ba (0,106%), 132Ba (0,101%), 134Ba (2,417%), 135Ba (6,592%), |
||
| Redox-Potenziale |
|
 |
© chemie-master.de - Website für den Chemieunterricht | Seitenübersicht| Lizenz & Urheberrecht| Arbeitsblätter | | Danksagungen | Kritik | Links | |
 |
| Quellenangabe für diese Seite: http://www.chemie-master.de/pse/pse.php?modul=Ba [Stand 28.02.2026] |
||
 |
||
