| chemie-master.de: CD-ROM-Fassung bestellen |
Das Periodensystem der Elemente für den Schulgebrauch |
zurück |
| Plutonium | |
7. Periode _______________ |
|
|
|
|
| Elementart: Metall | Oxidationsstufe(n): +5, +6 (+3, +4, +7) |
| Schmelztemperatur: 639,4 °C (912,5 K) | Elektronegativität: 1,3 |
| Siedetemperatur: 3230 °C (3503 K) | Atomradius: 151 pm |
| Dichte: 19,816 g/cm3 | Erdkrustenhäufigkeit: 2×10–19 % |
| Anordnung der Elektronen | |||||||||||||||||||
| 1s | 2s | 2p | 3s | 3p | 3d | 4s | 4p | 4d | 4f | 5s | 5p | 5d | 5f | .. | 6s | 6p | 6d | ... | 7s |
| 2 | 2 | 6 | 2 | 6 | 10 | 2 | 6 | 10 | 14 | 2 | 6 | 10 | 6 | 2 | 6 | 2 | |||
| Name | Benannt nach dem Planeten Pluto. | ||||||||||||||||||||||||||||||
| Entdeckung | 1940 erfolgte die Synthese von 238Pu durch McMillan, Kennedy und Wahl mittels Beschuss von Uranoxid mit Deuterium-Kernen. 239Pu wurde erstmals 1941 von Kennedy, Seaborg, Segré und Wahl durch Bestrahlung von Uran mit Neutronen hergestellt. Erste wägbare Mengen von Plutonium wurden unter der Leitung von Glenn T. Seaborg im August 1942 am Metallurgical Laboratory in Chicago ("Met Lab") erzeugt. |
||||||||||||||||||||||||||||||
| Eigenschaften | Sehr reaktionsfähiges, radioaktives Metall. Plutonium löst sich leicht in Salzsäure. Es ist unlöslich in Salpetersäure und konzentrierter Schwefelsäure.
Weiterführende Informationen: |
||||||||||||||||||||||||||||||
| Vorkommen | In der Natur nur in geringsten Spuren (in Uranmineralen wie Pechblende oder Carnotit) vorhanden. Vor mehr als 2 Milliarden Jahren gab es, wie Untersuchungen an dem Uranvorkommen von Oklo (Gabun) zeigen, eine natürliche Kernreaktion, bei der mehr als 4 Tonnen Plutonium gebildet wurden (siehe: 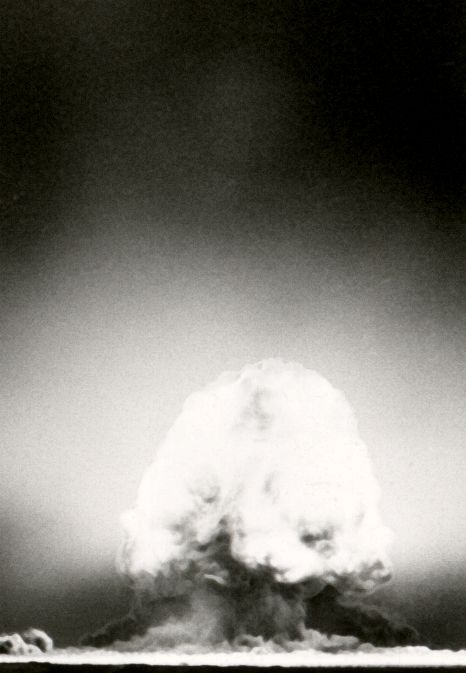
»Trinity«-Test: Am 16. Juli 1945 um 5:29:45 Uhr Ortszeit wurde zu Testzwecken in der Wüste von New Mexico (USA) die allererste Atomexplosion gezündet. 9 Kilogramm Plutonium wurden im Innern der Bombe zu einer Kugel zusammengepresst, um die Kernspaltungsreaktion auszulösen. Die entstandene Plutoniumkugel war nur ungefähr so groß wie eine Apfelsine, aber die von dieser Kugel ausgehende Explosion hatte eine Sprengkraft, die der von
|
||||||||||||||||||||||||||||||
| Verwendung | 239Pu findet auf Grund seiner Spaltbarkeit Verwendung als Kernbrennstoff und in Kernwaffen. Für militärische Zwecke wurden bisher weit über 100 Tonnen Plutonium produziert. 238Pu wird als Energiequelle in thermoelektischen Radionuklidbatterien zur Erzeugung von elektrischer Energie verwendet. Solche Radionuklidbatterien (RTG, "radioisotope thermoelectric generators") werden in Weltraumsonden eingebaut, die sich sehr weit von der Sonne entfernen, so dass Solarenergie aus Sonnenlicht nicht in ausreichendem Umfang erzeugt werden kann. Die Jupitersonde "Galileo" und die Saturnsonde "Cassini" wurden mit derartigen Energiequellen ausgestattet. Weiterführende Informationen: |
||||||||||||||||||||||||||||||
| Isotope |
|
||||||||||||||||||||||||||||||
| Redox-Potenziale |
|
||||||||||||||||||||||||||||||
 |
© chemie-master.de - Website für den Chemieunterricht | Seitenübersicht| Lizenz & Urheberrecht| Arbeitsblätter | | Danksagungen | Kritik | Links | |
 |





