| chemie-master.de: CD-ROM-Fassung bestellen |
Das Periodensystem der Elemente für den Schulgebrauch |
zurück |
| Schwefel | |
(Sauerstoff-Schwefel-Gruppe) 3. Periode ________________ 16. Gruppe (IUPAC 89) |
|
|
|
|
| Elementart: Nichtmetall | Oxidationsstufe(n): +6 (-2, +2, +4) |
| Schmelztemperatur: 115,21 °C (388,36 K) | Elektronegativität: 2,5 |
| Siedetemperatur: 444,72 °C (717,87 K) | Atomradius: 104 pm |
| Dichte: 1,96 g/cm3 | Erdkrustenhäufigkeit: 0,05 % |
| Anordnung der Elektronen | |||||||||||||||||||
| 1s | 2s | 2p | 3s | 3p | 3d | 4s | 4p | 4d | 4f | 5s | 5p | 5d | 5f | .. | 6s | 6p | 6d | ... | 7s |
| 2 | 2 | 6 | 2 | 4 | |||||||||||||||
| Schalenmodell | Lewis-Schreibweise | Energieniveauschema | |||||||||||||||||
 |
 |
 |
|||||||||||||||||
| Name | Lateinisch: »sulfur«. Das deutsche Wort geht zurück auf »swep« (Sanskrit für schlafen, vielleicht wegen der Giftigkeit des Schwefeldioxids). | ||||||||||||||||
| Entdeckung | Von alters her bekannt. | ||||||||||||||||
| Eigenschaften | Viele Modifikationen (S12, S8, S6, S4, S2 u.a.). Schwefel-Kristalle.  Der Schwefel in diesem Schwefelbrocken ist aus S8-Molekülen aufgebaut.
Bei gewöhnlicher Temperatur bildet Schwefel gelbe Kristalle. Er ist geruch- und geschmacklos. Schwefel ist unlöslich in Wasser, löst sich aber in Kohlenstoffdisulfid. Schwefel verbrennt mit blauer Flamme unter Bildung von Schwefeldioxid SO2 und Schwefeltrioxid SO3.
Schwefeldioxid + Wasser Schwefeltrioxid + Wasser Reagiert bei höherer Temperatur mit Metallen zu Sulfiden, mit Wasserstoff zu Schwefelwasserstoff H2S (Geruch von faulen Eiern). Die bei der Verbrennung von Kohle und Öl entstehenden Schwefeloxide sind Mitverursacher des »Sauren Regens«. |
||||||||||||||||
| Vorkommen | Gebunden als Sulfid (in Erzen) und als Sulfat (Gips, Baryt),
in Kohle und Erdöl, in Lebewesen (besonders in Haaren, Federn, Haut),
elementar in vulkanischen Gesteinen. Foto: Hanna Thum Schwefelabscheidung am Rand einer Fumarole, einer Erdspalte in vulkanischen Gebieten, aus der Wasserdampf und schwefelhaltige Gase austreten. Foto: Jan Dago  Der Vulkan Kawah Ijen auf der Insel Java (Indonesien) lässt 200 °C heißen flüssigen Schwefel aus seinem Inneren hervorsprudeln. Courtesy: NASA Visible Earth 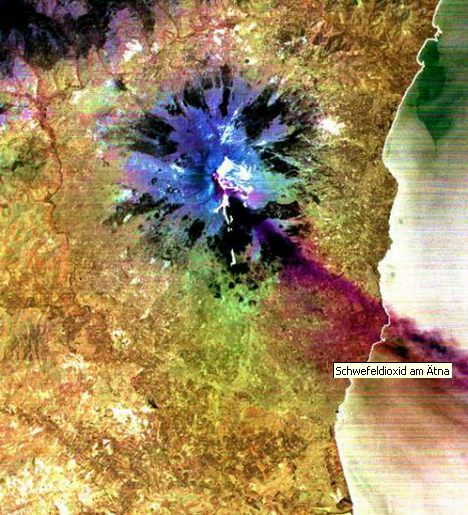 Die aus dem Schlot des Vulkans Ätna auf Sizilien herausgeschleuderten Gase enthalten Schwefeldioxid. Das durch Computerauswertung von Satellitenaufnahmen entstandene Falschfarbenbild zeigt das an sich farblose Schwefeldioxid in rotbrauner Farbe. |
||||||||||||||||
| Herstellung | Entschwefelung von Erdöl. Durch Entschwefelung von Erdgas gewonnener Schwefel auf einer Halde (Lacq/Frankreich). |
||||||||||||||||
| Verwendung | Produktion von Schwefelsäure H2SO4; Vulkanisieren von Kautschuk (Reifenproduktion); in Zündhölzern, Bioziden, Farben und Medikamenten. | ||||||||||||||||
| Isotope | 32S (95,02%), 33S (0,75%), 34S (4,21%), 36S (0,02%) | ||||||||||||||||
| Redox-Potenziale |
|
 |
© chemie-master.de - Website für den Chemieunterricht | Seitenübersicht| Lizenz & Urheberrecht| Arbeitsblätter | | Danksagungen | Kritik | Links | |
 |