| chemie-master.de: CD-ROM-Fassung bestellen |
Das Periodensystem der Elemente für den Schulgebrauch |
zurück |
| Rutherfordium | |
(Titangruppe) 7. Periode _______________ 4. Gruppe (IUPAC 89) |
|
|
|
|
| Elementart: Metall | Oxidationsstufe(n): – |
| Schmelztemperatur: – | Elektronegativität: – |
| Siedetemperatur: – | Atomradius: – |
| Dichte: – | Erdkrustenhäufigkeit: künstlich |
| Anordnung der Elektronen (Siehe auch: Relativistische Effekte und Energieniveauschema) | |||||||||||||||||||
| 1s | 2s | 2p | 3s | 3p | 3d | 4s | 4p | 4d | 4f | 5s | 5p | 5d | 5f | .. | 6s | 6p | 6d | ... | 7s |
| 2 | 2 | 6 | 2 | 6 | 10 | 2 | 6 | 10 | 14 | 2 | 6 | 10 | 14 | 2 | 6 | 2 | 2 | ||
| Name |
|
||
| Entdeckung | 1969 erstmals in Berkeley von einer Arbeitsgruppe um Ghiorso hergestellt. 22Ne + 242Pu |
||
| Eigenschaften | Kurzlebiges, radioaktives, nur künstlich darstellbares Element Nach der erstmaligen Herstellung des Rutherfordiums war die Frage von Interesse, ob dieses neue Element in seinen chemischen Eigenschaften mehr den Actinoiden oder mehr den Elementen Titan, Zirconium und Hafnium aus der Nebengruppe IV b (4. Gruppe) ähnelt. Erste experimentelle Beobachtungen (thermochromatografische Experimente von Zvara u.a. im Jahre 1969) zeigten, dass Rf ebenso wie Zr und Hf leichtflüchtige Chloride bildet, wohingegen die Chloride der Actinoiden nicht flüchtig sind. 1970 konnten Silva u.a. darlegen, dass auch im Bereich der wässrigen Chemie des Rutherfordiums Ähnlichkeiten zu den Elementen der 4. Gruppe des PSE bestehen. 1980 konnten Hulet u.a. anionische Chloridkomplexe herstellen, die denen des Hafniums entsprechen. Die Bildung dieser Komplexe ist von den dreiwertigen Actinoiden nicht bekannt. Es deutet - nach den bisherigen Experimenten zu urteilen - alles darauf hin, dass Rutherfordium ein Element der Nebengruppe IV b ist.  Die Abbildung zeigt das Verhalten der chemischen Homologen Hf, Zr und Th in trägerfreiem Zustand (geringste Konzentrationen) am Kationenaustauscher DOWEX 50WX8 in Abhängigkeit von der freien Fluoridionenkonzentration: Die Sorption von Zr und Hf nimmt ab einer Fluoridionenkonzentration von Information: Dr. A. Kronenberg Siehe zur Frage der experimentellen Schwierigkeiten: |
||
| Isotope |  Nur Radionuklide, keine stabilen Isotope. Nur Radionuklide, keine stabilen Isotope.Die Halbwertszeit von 260Rf beträgt 0,1 Sekunden. Die interessantesten Isotope sind 261Rf mit einer Halbwertszeit von 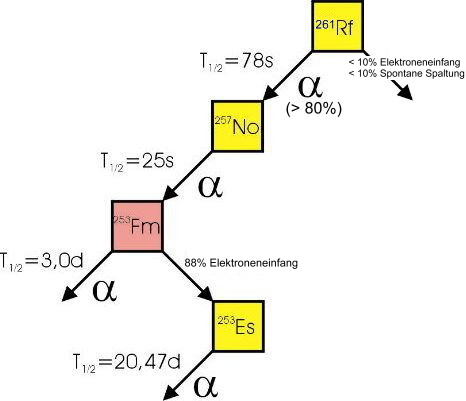 Zerfallskette von 261Rf.
Quelle: Dr. Kronenberg, Los Alamos National Laboratory, USA |
 |
© chemie-master.de - Website für den Chemieunterricht | Seitenübersicht| Lizenz & Urheberrecht| Arbeitsblätter | | Danksagungen | Kritik | Links | |
 |
