
 |
Lexikon "Fachbegriffe" |
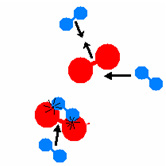
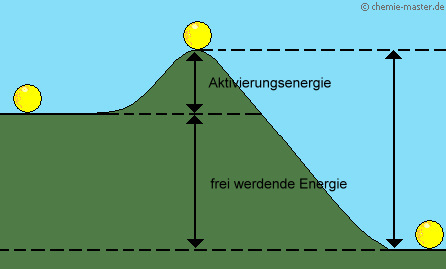
Die Aktivierungsenergie ist die Energie (Wärmemenge), die einem System anfänglich zugeführt werden muss, um darin eine Reaktion auszulösen.
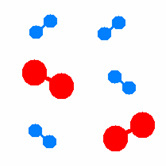
Beispiel: 2 H2 + O2 |
||
 |
 |
 |
Ausgangszustand der Edukte (= Ausgangsstoffe)
|
 ENERGIE (Wärme)
|
Reaktionsprodukte (= entstehende Stoffe)
|
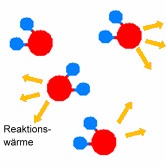
| Ist die Aktivierungsenergie einmal überwunden, so läuft die Reaktion weiter von selbst ab. Die durch die Reaktion frei werdende Energie reicht aus, weiterhin reaktionswirksame Zusammenstöße zu verursachen. | ||
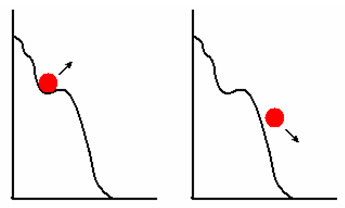 |
Die Kugel befindet sich oben am Berghang zunächst in einer metastabilen Lage. Wird sie angestoßen, so rollt sie von alleine den Berg hinunter. |
|
Siehe auch: Wirkungsweise von Katalysatoren am Beispiel der Knallgas-Reaktion